Bazė yra cheminis junginys, susidedantis iš OH–jonus ir priima protonus. Chemijos bazės yra tie junginiai, kurie nusidažo raudonai lakmuso mėlynumu ir, reaguodami su rūgštimi, neutralizuoja reakciją, kad susidarytų druska ir vanduo. Pagrindo pH vertė yra didesnė nei 7. Bazės yra kartaus skonio ir slidžios. Vandenyje tirpios bazės vadinamos šarmais. Bazių pavyzdžiai yra metalų oksidai, metalų hidroksidai ir kt. Muilas yra pagrindo, kurį naudojame kasdieniame gyvenime, pavyzdys. Šiame straipsnyje mes išsamiai sužinosime apie bazių apibrėžimą, savybes ir chemines reakcijas.

Bazinis apibrėžimas
Bazė apibrėžiama kaip cheminis junginys, kurio pH vertė yra didesnė nei 7, priima protoną, neutralizuoja rūgštį ir raudoną lakmusą paverčia mėlyna. Paprastai jie išlaisvina OH–jonas dėl disociacijos. Pavyzdžiui, NaOH, NaHCO3,ir tt Toliau pateikiamos kelios pagrindinės pagrindinės funkcijos:
- Jie turi kartaus skonio
- Jie yra slidūs liesdami
- Jie tampa raudoni lakmuso mėlyni
- Jie išlaisvina OH–jonų ištirpus vandenyje
- Jie praleidžia elektrą tirpalo pavidalu
Bazės yra vienas iš svarbiausių kasdieniame gyvenime naudojamų cheminių junginių. Bazės yra naudojamos kaip antacidiniai vaistai rūgštingumui kontroliuoti, o dantų pastoje – neutralizuoti bakterijų, kurios gamina rūgštį burnoje, ir apsaugo nuo emalio bei ertmės irimo. Jie taip pat naudojami kaip kepimo milteliai, soda ir skalbimo milteliai.
Lewiso bazė
Lewiso bazės yra junginiai, turintys elektronų porą ir gali paaukoti ją junginiams, kuriuose trūksta elektronų porų. Lewiso bazės savo prigimtimi yra nukleofilinės, ty jos myli branduolius, o tai reiškia, kad savo elektronų poromis puls į teigiamai įkrautą centrą. Lewiso bazės pavyzdžiai yra amoniakas, nes amoniake (NH3) centrinis atomas Azotas turi 5 elektronus, iš kurių 3 naudojami ryšiams su 3 vandenilio atomais sudaryti, o viena elektronų pora lieka prie azoto atomo, todėl susidaro NH3Lewiso bazė.
Arenijaus bazė
Pagal Arrhenius’o koncepciją, bazės yra junginiai, kurie ištirpę vandenyje išskiria hidroksido jonus ir padidina hidroksilo jonų koncentraciją vandeniniame tirpale. Pavyzdžiui, kai KOH ištirpsta vandenyje, jis duos OH–jonų ir taip padidinti OH koncentraciją–vandenyje.
Bronstedo bazė
Bronstedo bazės samprata yra patobulinta Arrhenius'o koncepcijos versija, kurioje teigiama, kad bazės yra junginiai, kurie priima H.+jonų arba protonų, kad susidarytų jų konjuguota rūgštis. Pavyzdžiui, Cl–yra bazė, kuri priima H+kad susidarytų HCl kaip jo konjuguota rūgštis.
Bazių tipai
Bazes galima klasifikuoti pagal rūgštingumą, koncentraciją ir jonizacijos gebėjimą. Klasifikacija nurodyta toliau
Bazių tipai pagal rūgštingumą
Bazės rūgštingumas reiškia pakeičiamų hidroksilo grupių, esančių vienoje bazės molekulėje, skaičių. Pagal rūgštingumą bazės skirstomos į tris kategorijas:
- Monorūgštinė bazė
- Diacidinė bazė
- Trirūgštinė bazė
Monorūgštis: Monorūgštinės bazės yra tos, kuriose yra tik vienas keičiamas hidroksilo jonas ir kurios sąveikauja tik su vienu vandenilio jonu. Monorūgštinės bazės apima NaOH, KOH ir kt.
Diacidinis: Diacidinė bazė yra bazė su dviem keičiamais hidroksilo jonais, kurie sąveikauja su dviem vandenilio jonais. Ca(OH)2, Mg(OH)2, ir kitos dvirūgštinės bazės yra pavyzdžiai.
Trirūgštis: Trirūgštinė bazė yra bazė, kurią sudaro trys keičiami hidroksilo jonai ir trys vandenilio jonai. Trirūgštinės bazės apima Al(OH)3, Fe(OH)3, ir kiti.
Bazių tipai pagal jų koncentraciją vandeniniame tirpale
Koncentracija reiškia bazės kiekį vandeniniame tirpale. Pagal koncentraciją vandeniniame tirpale bazės skirstomos į dvi kategorijas:
- Koncentruota bazė
- Praskiestas pagrindas
Koncentruota bazė: Koncentruotos bazės yra tos, kuriose bazės kiekis yra didelis, palyginti su tirpikliu. Pavyzdžiui, koncentruotas NaOH tirpalas.
Praskiestas pagrindas: Šių tipų bazių vandeniniame tirpale bazių koncentracija yra mažesnė. Skiedimas yra tirpios medžiagos procentinės dalies sumažinimo procesas, pridedant daugiau tirpiklio. Pavyzdžiui, praskieskite NaOH, praskieskite KOH ir pan.
java pagrindinis
Bazių tipai pagal jonizacijos laipsnį
Jonizacijos laipsnis reiškia cheminio junginio gebėjimą išlaisvinti juos sudarančius jonus, kai jie ištirpinami vandenyje. Bazės atveju jonizacijos laipsnis reiškia bazės gebėjimą išskirti OH–jonų, kai jie ištirpsta vandenyje. Pagal jonizacijos laipsnį bazės skirstomos į du tipus:
- Stipri bazė
- Silpna bazė
Stiprus pagrindas: Stipriosios bazės yra tos bazės, kurios visiškai disocijuoja ir išskiria OH-joną, kai ištirpsta vandenyje. Kai kurie stiprių bazių pavyzdžiai yra NaOH, KOH ir kt.
Silpna bazė: Bazės, kurios visiškai neišsiskiria ir išskiria tik dalį OH-jono, vadinamos silpnąja baze. Silpnųjų bazių pavyzdžiai yra Al(OH)3,Cu(OH)2,ir tt
Sužinokite daugiau, Stiprios ir silpnos bazės
Bazių savybės
Kaip žinome, bazės yra cheminiai junginiai, kurie turi OH-joną, nusidažo raudonai lakmuso mėlynumu ir pan. Šiame skyriuje sužinosime apie fizines ir chemines bazių savybes bei trumpas žinias apie jų bendrąsias savybes.
Bendrosios pagrindo savybės
Žemiau pateikiamos bendrosios bazių savybės:
- Hidroksido jonas (OH–) į vandenį išleidžiamos bazės. Kuo stipresnis tampa pagrindas, nes išsiskiria daugiau jonų.
- Bazės reaguoja su rūgštimi ir susidaro druska Rūgštys reaguoja su bazėmis. Ši bazės reakcija su rūgštimi vadinama neutralizacijos reakcija.
- Pagrindai raudoną lakmusą paverčia mėlyna spalva.
- Baltymų struktūrą gali pakeisti bazės. Bazės turi tokią kokybę, todėl jos jaučiasi glotnios. Muilas yra pagrindas, kuris sušlapęs tampa neįtikėtinai slidus. Dėl gebėjimo modifikuoti baltymų struktūrą kai kurios galingos bazės yra itin pavojingos.
Bazių fizinės savybės
Pagrindo skonis kartaus: Pagrindai kartaus skonio. Dėl savo kartumo turime vos kelis šarminius maisto produktus. Yra tik keletas šarminių maisto medžiagų. Bazes reikia ragauti atsargiau nei rūgštis.
Pagrindai yra slidūs liečiant: Palietus pagrindai jaučiasi slidūs. Pavyzdžiui, muilas.
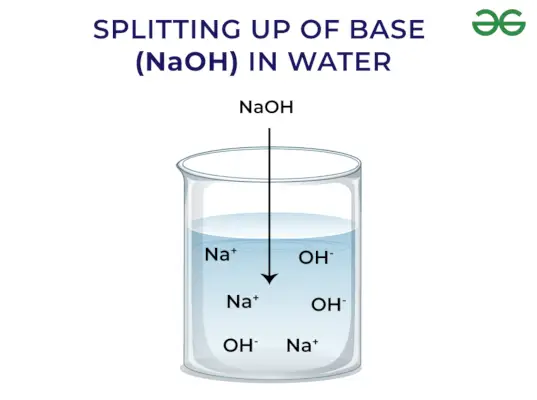
Bazės išskiria OH – Jonas: Kai bazės ištirpsta vandenyje, jos išskiria hidroksilo joną (OH–). Priklausomai nuo gebėjimo išlaisvinti hidroksilo jonus, jie skirstomi į stiprius ir silpnus.
geriausi automobiliai pasaulyje
Bazės neutralizuoja rūgštis: Kai bazės reaguoja su rūgštimis, jos neutralizuoja viena kitą ir gamina druską bei vandenį. Ši reakcija vadinama Neutralizacijos reakcija . Tarkime, kad turime rūgštį HY ir bazę „XOH“, tada susidariusi druska bus „XY“. Šios reakcijos lygtis gali būti pateikta kaip HY + XOH → HOH + XY.
Denatūruotų baltymų bazės: Baltymų denatūravimas reiškia baltymo stabilumo ir struktūros sunaikinimą. Dėl to naudojama žmonėms kenksminga bazė, nes žmogaus oda ir plaukai yra sudaryti iš baltymų, o kai naudojami stiprūs šarmai, tokie kaip natrio arba kalio hidroksidas, dar vadinami šarmu, jie daro žalingą poveikį žmogaus odai.
Pagrindai raudoną lakmusą paverčia mėlyna: Kai pagrindai liečiasi su raudonu lakmusu, jie tampa mėlyni. Tačiau reikia pažymėti, kad tokio pokyčio negalima pastebėti, kai bandome reaguoti sausą pagrindą su raudonu lakmuso popieriumi. Lakmuso popieriaus testas yra vienas iš seniausių bazinio tyrimo metodų. Tačiau yra ir kitų rodiklių, tokių kaip fenolftaleinas
Bazės praleidžia elektrą: Kai bazės yra tirpalo pavidalo, jos turi judrų OH-joną, todėl gali laiduoti elektrą.
Bazių cheminės savybės
- Bazinės medžiagos reakcija su metalais: Kai šarmas (bazė) reaguoja su metalu, susidaro druska ir vandenilio dujos.
Šarmas + metalas → druska + vandenilis
Pavyzdžiai:
- Kai natrio hidroksidas sąveikauja su aliuminio metalu, susidaro natrio aliuminatas ir vandenilio dujos.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Kai natrio hidroksidas sąveikauja su cinko metalu, jis gamina vandenilio dujas ir natrio cinkatą.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Nemetalų oksidų reakcija su baze: Nemetaliniams oksidams reaguojant su baze susidaro druska ir vanduo.
Nemetalinis oksidas + bazė → druska + vanduo
Kai kalcio hidroksidas, bazė reaguoja su anglies dioksidu, tada susidaro kalcio karbonatas ir vanduo.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
- Šarmų / bazės reakcija su amonio druskomis: Amoniakas susidaro šarmams reaguojant su amonio druskomis.
Šarmas + Amonio druska → Druska + Vanduo + Amoniakas
Kai kalcio hidroksidas reaguoja su amonio chloridu, susidaro kalcio chlorido vanduo ir amoniakas.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Bazių pavyzdžiai
Bazės paprastai yra metalo oksidas, metalo hidroksidas, metalo vandenilio karbonatas, metalo karbonatai ir kt. Pažiūrėkime kai kuriuos bazių pavyzdžius ir jų pritaikymą lentelės forma:
| Bazės | Programos |
|---|---|
| Kalio hidroksidas KOH | Naudojamas šarminėse baterijose |
| Natrio hidroksidas NaOH | Naudojamas muilo ir ploviklių gamyboje |
| Magnio hidroksidas Mg(OH) 2 | Naudojamas kaip antacidiniai vaistai |
| Natrio bikarbonatas NaHCO 3 | Naudojama kaip kepimo soda |
| Natrio karbonatas jau 2 CO 3 | Naudota kaip skalbimo soda |
| Amoniakas NH 3 | Naudojamas valymo ir farmacijos produktų gamyboje myflixr |
| Kalcio hidroksidas Ca(OH) 2 | Naudojamas White Washing |
Bazių panaudojimas
Yra įvairių bazės naudojimo atvejų, kai kurie iš jų yra:
- Natrio hidroksidas naudojamas muilo ir popieriaus gamyboje. Natrio hidroksidas (NaOH) taip pat naudojamas viskozės gamyboje.
- Balinimo milteliai pagaminti iš Ca(OH)2, paprastai žinomas kaip gesintos kalkės arba kalcio hidroksidas.
- Kalcio hidroksidas naudojamas gaminant sausus mišinius dažymui ir dekoravimui.
- Magnio hidroksidas, liaudiškai žinomas kaip magnezijos pienas, yra plačiai naudojamas vidurius laisvinantis vaistas. Jis taip pat naudojamas kaip antacidinis vaistas, nes mažina rūgštingumą žmogaus skrandyje.
- Laboratorijose amonio hidroksidas yra kritinis reagentas.
- Gesintosios kalkės gali būti naudojamos rūgštingumo pertekliui dirvožemyje neutralizuoti.
Skaityti daugiau
- Rūgštis, bazė ir druska
- Rūgšties stiprumas
- Rūgščių ir bazių jonizacija
DUK apie chemijos bazes
1. Kas yra bazės?
- Baziniai junginiai turi kartaus skonio.
- Daugumos bazių tekstūra yra muiluota.
- Išbandžius ant lakmuso popieriaus, jis dažniausiai raudoną lakmuso popierių paverčia mėlynu lakmuso popieriumi.
- Tirpale baziniai junginiai taip pat praleidžia elektrą.
- Baziniams junginiams ištirpus vandenyje, išsiskiria OH- jonai.
2. Kokios yra bazių funkcijos?
Namuose bazes naudojame kaip valymo priemones ir antacidinius vaistus. Muilas, šarmas (kuris naudojamas orkaitės valikliams), magnezijos pienas ir tumai yra populiarių naminių pagrindų pavyzdžiai. Kiekvieno iš jų pH yra didesnis nei septyni, gali vartoti laisvą vandenilį ir neutralizuoti rūgštis.
3. Koks yra svarbiausias skirtumas tarp rūgšties ir bazės?
Rūgštys ir bazės yra dviejų tipų ėsdinančios cheminės medžiagos. Rūgščių medžiagų pH vertė yra nuo 0 iki 7, o bazių pH vertė yra nuo 7 iki 14. Rūgštys yra joninės cheminės medžiagos, kurios suyra vandenyje ir sukuria vandenilio joną (H+), o bazė disocijuoja ir sudaro OH- joną.
4. Kokios yra bazių fizinės savybės?
- Jie turi kartaus skonio.
- Jų vandeniniai tirpalai pasižymi muilu.
- Jie keičia lakmuso popieriaus spalvą iš raudonos į mėlyną.
- Jų vandeniniai tirpalai yra laidūs elektrai.
- Išsiskirus vandenilio dujoms, bazės reaguoja su metalais ir susidaro druska.
5. Kas atsitiks, kai kalcio hidroksidas sureaguos su amonio chloridu?
Kai kalcio hidroksidas reaguoja su amonio chloridu, susidaro kalcio chlorido vanduo ir amoniakas.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Kas atsitiks, kai natrio hidroksidas sureaguos su metalu cinku?
Kai natrio hidroksidas sąveikauja su cinko metalu, jis gamina vandenilio dujas ir natrio cinkatą.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Kas yra Lewiso bazė?
Lewiso bazė yra junginiai, kurie dovanoja elektronų porą junginiui, kuriam trūksta elektronų. Pavyzdys apima NH3.
8. Iš ko gaminamos bazės?
Bazes paprastai sudaro OH–jonų. Be šių metalų oksidų, karbonatai ir vandenilio karbonatai taip pat yra bazės.
9. Kas yra šarmai?
Vandenyje tirpios bazės vadinamos šarmais. Pavyzdys yra natrio hidroksidas NaOH.
10. Kas yra stipri bazė ir silpna bazė?
Bazės, kurios visiškai disocijuoja ir sudaro OH–jonai, ištirpę vandenyje, vadinami stipria baze. Pavyzdžiui, NaOH. Silpnos bazės yra tos, kurios visiškai neišsiskiria, kad išlaisvintų OH–jonas vadinamas silpnąja baze. Silpnų bazių pavyzdžiai yra amonio hidroksidas.
