Aufbau principas yra pagrindinis metodas, nurodantis, kaip elektronai užpildomi atominėje orbitoje. Pagal Aufbau principą, elektronų užpildymas pagrindinėje atomo būsenoje vyksta pagal pagrindinį modelį. Šis principas mums sako, kad bet kurių atomų atominėje orbitoje esantys elektronai užpildomi didėjančia jų energijos tvarka ir, norėdami rasti atominės orbitos energiją, jie vadovaujasi n+l taisykle.
Struktūros principas
Šiame straipsnyje mes išsamiai sužinosime apie Aufbau principą, Aufbau principo ypatybes, jo išimtis ir apribojimus.
Struktūros principo apibrėžimas
Aufbau principas teigia, kad
Įvairiose orbitalėse esantys elektronai užpildomi didėjančia jų energijos tvarka, t. y. pirmiausia bus užpildyta mažiausią energiją turinti orbita, o paskutinė.
Žodis „Aufbau“ vokiečių kalboje reiškia „statymasis“. Orbitalių susidarymas reiškia orbitalių užpildymą elektronais. Jame teigiama, kad elektronai atominėse orbitalėse užpildyti atominės orbitos energijos didėjančia tvarka. O atominės orbitos energija apskaičiuojama taikant n+l taisyklę, kuri nusako, ar elektronas, turintis didesnį n+l reikšmės skaičių, turi didesnę energiją. Taisyklėje, aptartoje ankstesnėje eilutėje, n pasako pagrindinį kvantinį skaičių ir l nurodo azimutinį kvantinį skaičių.
Jei du elektronai turi vienodą n+l reikšmę, tai elektronas, kurio vertė mažesnė n turi mažesnę energiją ir pirmiausia užpildoma. Toliau aptariama elektronų užpildymo atominėje orbitoje tvarka.
Principinės diagramos struktūra
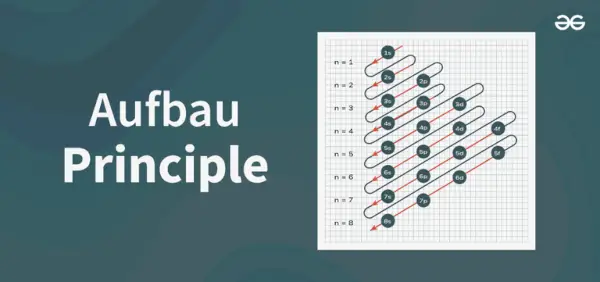
Aufbau principo diagrama yra diagrama, vaizduojanti elektronų užpildymo atome tvarką.
Principinės diagramos struktūra
Pagrindinės formulės struktūra
Aufbau principo formulė yra formulė, nurodanti elektronų užpildymo atominėje orbitoje tvarką. Atominė orbitos formulė yra
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Principinė 11 klasės struktūra
Aufbau principas yra svarbus chemijos principas 11 klasės mokiniams. Šis principas teigia, kad
Atomo atominėje orbitoje esantys elektronai užpildomi didėjančia atominės orbitos energijos tvarka, kuri apskaičiuojama taikant (n+l) taisyklę.
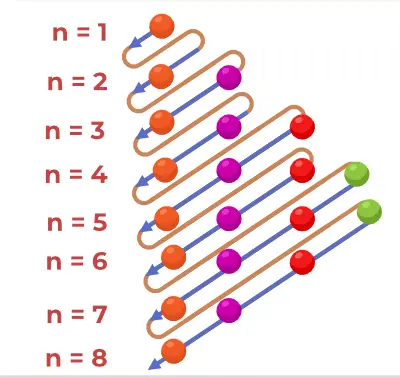
Struktūros schemos braižymas
Aufbau diagrama nubraižyta naudojant toliau nurodytus veiksmus,
osi modelio sluoksniai
- Raskite elektronų skaičių, kuris turi būti užpildytas atomais.
- Mes žinome, kad atome
- s-orbitalėje gali būti daugiausiai 2 elektronai.
- p-orbitalė gali talpinti daugiausiai 6 elektronus.
- d-orbitalėje gali būti daugiausia 10 elektronų.
- f-orbitale gali tilpti daugiausia 14 elektronų.
- 1s orbitoje užpildykite pirmuosius du elektronus.
- Tada vadovaukitės n+l taisykle ir atitinkamai užpildykite elektronus.
Svarbiausi struktūros principo bruožai
Įvairios Aufbau principo savybės yra
- Orbitos energija priklauso nuo pagrindinio kvantinio skaičiaus (n) ir azimutinės sumos skaičiaus (I) reikšmių sumos. Tai vadinama (n + l) taisyklė . Pagal šią taisyklę,
- Neutraliame izoliuotame atome, kuo mažesnė (n + l) orbitos reikšmė, tuo mažesnė jo energija. Tačiau jei dviejų skirtingų tipų orbitalės turi tą pačią reikšmę (n + l), tai orbitalės, kurių n reikšmė mažesnė, turi mažiau energijos.
| Orbitos tipas | n vertė | l vertė | n+l reikšmė | Santykinė energija |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Mažiausia energija |
| 2s | 2 | 0 | 2+0 = 2 | Didesnė energija nei 1s orbita |
| 2p 3s | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p orbitalės(n=2) turi mažesnę energiją nei 3s(n=3) orbitalės. |
| 3p 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | 3p orbitalės(n=3) turi mažesnę energiją nei 4s(n=4) orbitalės. |
| 3d 4p | 3 gimp eksportuoti kaip jpg 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d orbitalės(n=3) turi mažesnę energiją nei 4p(n=4) orbitalės. |
Iš lentelėje pateikto aprašymo matyti, kad įvairių orbitų energijos didėja didėjant pagrindinio kvantinio skaičiaus skaičiui.
- Taigi tvarka, kuria elektronai užpildomi atominėje orbitoje atomas yra, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Elektroninė konfigūracija naudojant Aufbau principą
The elektroninė konfigūracija Aufbau principo naudojimas keliems elementams aptariamas toliau:
Sieros elektronų konfigūracija
Atominis skaičius Sieros yra 16, ty turi 16 elektronų
Cassidy Hutchinson išsilavinimas
Dabar naudojant Aufbau principą elektroninė sieros konfigūracija parašyta taip:
[S] = 1 s 2 2s 2 2p 6 3s 2 3p 4
Azoto elektronų konfigūracija
Azoto atominis skaičius yra 7, ty jis turi 7 elektronus
Dabar naudojant Aufbau principą, elektroninė azoto konfigūracija parašyta taip:
[N] = 1 s 2 2s 2 2p 3
Konstravimo principo išimtys
Yra keletas Aufbau principo išimčių, kurios yra chromas ir varis. Jų elektroninė konfigūracija yra
Elektroninė „Chromium“ konfigūracija
Elektroninė Chromium konfigūracija pagal Aufbau principą turėtų būti
- Cr(24): [Ar]3d 4 4s 2
Tačiau aukščiau pateikta konfigūracija nėra teisinga, nes tikroji elektroninė Chromium(Cr) konfigūracija yra
- Cr(24): [Ar]3d 5 4s 1
Šios elektroninės konfigūracijos priežastis yra ta, kad pusiau užpildyta d-atominė orbita yra stabilesnė nei orbitalė, užpildyta pagal Aufbau principą.
Elektroninė vario konfigūracija
Elektroninė vario konfigūracija pagal Aufbau principą turėtų būti
- Cu(29): [Ar]3d 9 4s 2
Aukščiau pateikta konfigūracija neteisinga, nes tikroji elektroninė vario (Cu) konfigūracija yra
- Cu(29): [Ar]3d 10 4s 1
Šios elektroninės konfigūracijos priežastis yra ta, kad pilnai užpildyta d-atominė orbita yra stabilesnė nei orbitalė, užpildyta pagal Aufbau principą.
Skaityti daugiau
- Kvantiniai skaičiai
- Atominių orbitalių forma
- Atominė struktūra
Struktūros principas – DUK
Kas yra Aufbau principas chemijoje?
Aufbau principas chemijoje yra pagrindinis principas, naudojamas užpildyti elektronus bet kurio atomo atominėse orbitose. Ši teorema mums nurodo, kokia tvarka elektronai užpildomi atominėje orbitoje.
Kas davė Aufbau principą?
Aufbau principą 1920 m. pateikė garsus danų fizikas Nielsas Bohras.
Kas yra Pauli išskyrimo principas?
Pauli išskyrimo principas teigia, kad atome nėra dviejų elektronų, turinčių visus keturis kvantinius skaičius t jis tas pats. Bent jau vienas iš kvantinių skaičių skiriasi visiems atomo elektronams.
Kas yra n+l taisyklė?
n+l taisyklė yra taisyklė, nurodanti, kad orbitos energija priklauso nuo pagrindinio kvantinio skaičiaus(n) ir azimutinio kvantinio skaičiaus(l) sumos. ši taisyklė vadinama (n+l) taisykle.
Kokios yra Aufbau principo išimtys?
Aufbau principo išimtis yra
- Elektroninė „Chromium Cr“ konfigūracija[24]
- Elektroninė vario vario konfigūracija[29]
