Atominės orbitos , kurios yra matematinės funkcijos, apibūdina elektronų (arba elektronų porų) banginį elgesį atome. Atominės orbitos yra skirtingos formos, atsižvelgiant į jų tipą. Skirtingos atominių orbitų formos apibūdina tai, kad yra arba didžiausia, arba nulinė tikimybė rasti elektroną aplink branduolį tam tikromis kryptimis. Yra keturių tipų orbitos, kurių kiekviena turi skirtingą formą ir vaizduojama raidėmis s, p, d ir f. Atsižvelgiama į s ir p orbitales, nes jų yra daugiausia cheminėje ir biologinėje chemijoje. An s-orbitalė centre yra sferinis branduolys, a p-orbital yra hantelio formos ir keturi iš penkių d orbitalės yra dobilo lapo formos. Penktoji d orbita sukurta kaip ilgas hantelis su spurga centre. Atomo orbitos yra suskirstytos į sluoksnius arba elektronų apvalkalus.
Kas yra atominės orbitalės?
Atominės orbitos yra trimatė erdvė šalia atomo branduolio, kurioje elektrono atradimo galimybė yra didžiausia.
Atomas, pagal kvantinio atomo modelį, gali turėti begalinį skaičių orbitų. Šios orbitos gali būti klasifikuojamos pagal jų dydį, formą ar orientaciją. Siauresnė orbita reiškia, kad yra didesnė tikimybė sugauti elektroną arti branduolio. Orbitinės bangos funkcija dažnai žinoma kaip matematinė funkcija, naudojama elektrono koordinatėms išreikšti. Tikimybę surasti elektroną parodo orbitinės bangos funkcijos kvadratas. Ši bangos funkcija taip pat padeda sukurti ribines paviršiaus diagramas.
Orbitinės bangos funkcija
The kvantinis atominis modelis prognozuoja, kad atomas gali turėti daugybę orbitų. Šios orbitos gali būti sugrupuotos pagal jų dydį, geometriją ar polinkį. Sumažėjęs orbitos dydis padidina tikimybę gauti elektroną arti branduolio. Matematinė funkcija, naudojama elektrono koordinatėms pavaizduoti, vadinama orbitinės bangos funkcija . Tikimybę atrasti elektroną parodo orbitinės bangos funkcijos kvadratas.
Šią bangų funkciją taip pat galime naudoti kurdami ribines paviršiaus diagramas. Mes galime geriau suprasti orbitalių formą, naudodami įvairių orbitalių pastovaus tikimybės tankio ribines paviršiaus diagramas.
c struktūra struktūroje
Atominių orbitalių formos
Atominių orbitalių formos skiriasi. Tai reiškia, kad jų aprašomų elektronų, supančių branduolį, tikimybių pasiskirstymas yra skirtingas. Faktas, kad skirtingose orbitose esantys elektronai greičiausiai yra skirtingose srityse aplink pagrindinį branduolį ir dėl to patiria skirtingo stiprumo pastarojo trauką, yra viena iš priežasčių, kodėl orbitalių energija skiriasi. Stebina tai, kad visos orbitos tam tikrame vandenilio atomo apvalkale turi tą pačią energiją, tačiau turi skirtingas formas. Taip yra dėl įvairių su energija susijusių įmokų panaikinimo.
Tačiau kai tik atsiranda antrasis elektronas, išsigimimas išnyksta.
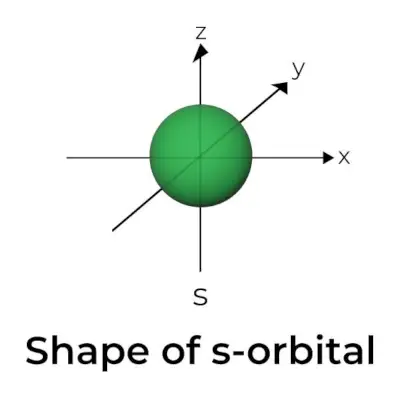
S-orbitalės forma
- S orbitos ribinio paviršiaus diagrama primena sferą, kurios centre yra branduolys, kurį galima pavaizduoti dviem matmenimis kaip apskritimą.
- s-orbitalės yra sferiškai simetriškos, o tai reiškia, kad tikimybė rasti elektroną tam tikru atstumu yra vienoda visomis kryptimis.
- Taip pat parodyta, kad s orbitos dydis didėja didėjant pirminio kvantinio skaičiaus (n) reikšmei; vadinasi, 4s> 3s> 2s> 1s.
- Mazgo taškas yra vieta, kurioje nėra galimybės nustatyti elektrono vietos. Mazgai skirstomi į du tipus: radialinius mazgus ir kampinius mazgus. Atstumas nuo branduolio apskaičiuojamas pagal radialinius mazgus, o orientaciją – pagal kampinius mazgus.
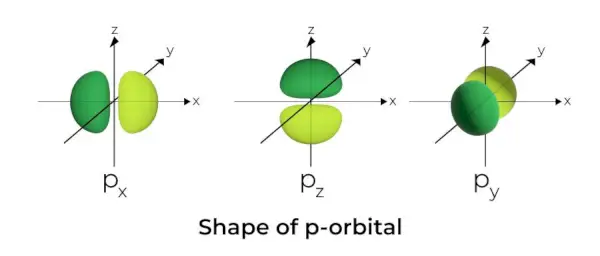
P-Orbital forma
- P orbitalės formuojamos kaip hanteliai.
- P orbitinis mazgas yra branduolio centre.
- Dėl trijų orbitalių p orbitalė gali užimti daugiausia šešis elektronus.
- Kiekvieną p orbitalę sudaro dvi dalys, žinomos kaip skiltys, esančios abiejose plokštumos, einančios per branduolį, pusėse.
- Kiekviena p orbita turi dalis, žinomas kaip skiltys, abiejose plokštumos, einančios per branduolį, pusėse. Plokštumoje, kurioje susikerta dvi skiltys, tikimybė rasti elektroną yra nulinė.
- Trys orbitos yra žinomos kaip išsigimusios orbitos, nes jų dydis, forma ir energija yra vienodi.
- Vienintelis skirtumas tarp orbitų yra skilčių orientacija. Kadangi skiltelės yra orientuotos išilgai x, y arba z ašių, joms suteikiami pavadinimai 2px, 2py, ir 2pz. Mazgų skaičiui apskaičiuoti naudojama formulė n –2.
- Panašiai kaip s orbitalių, p orbitalių dydis ir energija didėja didėjant pirminiam kvantiniam skaičiui (4p> 3p> 2p).
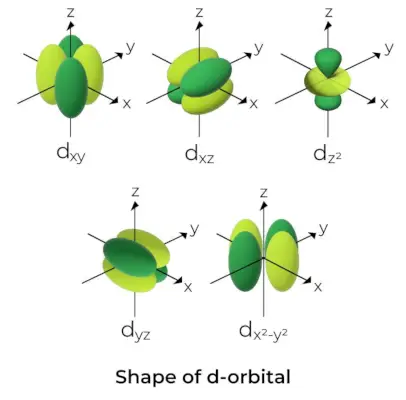
D-Orbital forma
- D orbitalių magnetinės orbitos kvantinis skaičius pateikiamas kaip (-2,-1,0, 1,2). Dėl to galime teigti, kad yra penkios d-orbitalės.
- Šios orbitos žymimos simboliais dxy, dyz, dxz, dx2- ir2, ir dSu2.
- Pirmųjų keturių d orbitalių formos yra panašios viena į kitą, o tai skiriasi nuo dSu2orbitalės, bet visų penkių d orbitalių energija yra vienoda.
f-Orbital forma
- F orbitos forma yra išsklaidyta. Kadangi f orbitalės reikšmė l=3, minimali pirminio kvantinio skaičiaus n reikšmė yra 4.
- F orbitalės ekvivalentinės ml vertės yra (-3, –2, –1, 0, +1, +2, +3).
- Dėl to l = 3 yra septynios f orbitalės.

listnode java
Išsigimusios orbitos
Degeneruotos orbitos yra tos, kurių energija yra tokia pati. Šios orbitos yra skirtingos (jos gali būti skirtingai orientuotos erdvėje aplink atomo branduolys ), tačiau jie turi tą pačią energiją. Esant išoriniam laukui, p orbitos degeneracija nepaveikiama; tačiau f ir d orbitalių išsigimimą galima nutraukti pritaikius sistemai išorinį lauką (elektrinį arba magnetinį).
Kai kurios orbitos turės didesnę energiją, o kitos – mažesnę. Degeneracijos sistemoje nebebus. Pavyzdžiui, d orbitalės yra sudarytos iš penkių išsigimusių orbitalių, kurių visų energija yra tokia pati.
Skaityti daugiau:
- Molekulinės orbitos teorija
- Orbitos užpildymas atome
- Hibridizacija
DUK apie atominių orbitalių formas
1 klausimas: kaip veikia orbitos?
sql serverio pivotas
Atsakymas:
Atominė orbitalė yra matematinė išraiška, išreiškianti vieno elektrono ar elektronų poros atomo elgseną atomo teorijoje ir kvantinėje mechanikoje. Kiekviena orbita užims daugiausia du elektronus, kurių kiekvienas turi savo sukimosi kiekį.
2 klausimas: kas yra mazginė plokštuma?
Atsakymas:
Plokštuma, kurioje tikimybė rasti elektroną yra nereikšminga arba lygi nuliui, vadinama mazgo plokštuma.
do ir while ciklas java
3 klausimas: kiek yra orbitų?
Atsakymas:
Kadangi s polygis turi tik vieną orbitą, gali būti tik du elektronai. Kadangi p polygis susideda iš trijų orbitų, gali būti ne daugiau kaip šeši elektronai. Kadangi d polygis susideda iš 5 orbitalių, gali būti daugiausia 10 elektronų. Ir kiekvienas iš keturių polygių turi septynias orbitales, kuriose gali būti daugiausia 14 elektronų.
4 klausimas: kurios orbitos turi didžiausią energiją?
Atsakymas:
bash if teiginys
Orbita 1 turi daugiausia energijos. Elektrono energija yra energijos kiekis, reikalingas jam pašalinti iš atomo elektrinio burbulo.
5 klausimas: kuo skiriasi apvalkalas nuo orbitalės?
Atsakymas:
Atome apvalkalas yra tos pačios kvantinių skaičių teorijos, n, posluoksnių rinkinys. Kiekviena orbita turi po du elektronus, o toje pačioje orbitoje esantys elektronai turi tą patį dydžio, kampinio momento dydžio ir magnetinio kvantinio skaičiaus apibrėžimą.
6 klausimas: kas yra sigma ir pi ryšys?
Atsakymas:
Atominės orbitos persidengimas sukuria sigma ir pi ryšius. Sigma ryšiai sukuriami persidengiant atominėms orbitos skiltims, o Pi ryšiai susidaro, kai viena atominė orbitos skiltis sutampa su kita.
