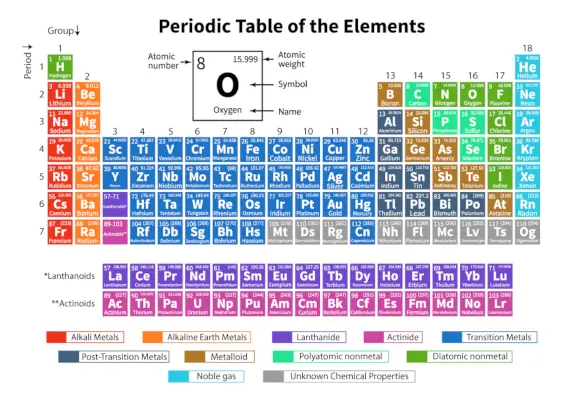
The Periodinė elementų lentelė elementų yra sistemingas 118 žinomų cheminių elementų išdėstymas. Šie cheminiai elementai yra išdėstyti didėjančio atominio skaičiaus tvarka. Horizontalios eilutės iš kairės į dešinę vadinamos taškais, o vertikalios stulpeliai iš viršaus į apačią – periodinės lentelės grupėmis.
Turinys
- Kas yra periodinė lentelė?
- Periodinės lentelės elementų sąrašas
- Svarbūs terminai periodinėje lentelėje
- Elementų klasifikacija periodinėje lentelėje
- Mendelejevo periodinė lentelė
- DUK apie periodinę elementų lentelę
Kas yra periodinė lentelė?
Periodinė lentelė yra lentelės atvaizdas, kuriame visi žinomi cheminiai elementai yra išdėstyti horizontaliose eilutėse, vadinamose taškais, ir vertikaliomis stulpeliais, vadinamomis grupėmis pagal jų dydį. atominis skaičius ir atitinkamai atominę struktūrą.
Tai visų žinomų elementų išdėstymas, todėl pateikiama informacija apie elementus, tokius kaip jų masė, elektronų skaičius, elektronų konfigūracija ir unikalios cheminės savybės.
Periodinės lentelės elementų sąrašas
Čia yra lentelė, vaizduojanti 118 periodinės lentelės elementų. Išvardyti elementai yra išdėstyti pagal didėjančią atominio skaičiaus tvarką ir atitinkamą jų atominį svorį, simbolį, tankį ir elektronegatyvumą.
| Atominės masės periodinės lentelės elementai | |||||
|---|---|---|---|---|---|
| Atominis skaičius | Cheminio elemento pavadinimas | Simbolis | Atominė masė (amu) | Tankis (g/cm 3 ) | Elektronegatyvumas |
| 1 | Vandenilis | H | 1,0079 | 0,00008988 | 2.2 |
| 2 | Helis | Jis | 4.0026 | 0,0001785 | – |
| 3 | Ličio | Tai | 6 941 | 0,534 | 0,98 |
| 4 | Berilis | Būk | 9.0122 | 1.85 | 1.57 |
| 5 | Boras | B | 10 811 | 2.34 | 2.04 |
| 6 | Anglies | C | 12.0107 | 2 267 | 2.55 |
| 7 | Azotas | N | 14.0067 | 0,0012506 | 3.04 |
| 8 | Deguonis | O | 15.9994 | 0,001429 | 3.44 |
| 9 | Fluoras | F | 18.9984 | 0,001696 | 3.98 |
| 10 | Neoninis | Taip | 20.1797 | 0,0009002 | – |
| vienuolika | Natrio | jau | 22.9897 | 0,968 | 0,93 |
| 12 | Magnis | Mg | 24 305 | 1 738 | 1.31 |
| 13 | Aliuminis | Į | 26.9815 | 2.7 | 1.61 |
| 14 | Silicis | Taip | 28.0855 | 2 329 | 1.9 |
| penkiolika | Fosforas | P | 30.9738 | 1 823 | 2.19 |
| 16 | Siera | S | 32 065 | 2.07 | 2.58 |
| 17 | Chloras | Cl | 35 453 | 0,0032 | 3.16 |
| 18 | Argonas | Su | 39 948 | 0,001784 | – |
| 19 | Kalis | K | 39.0983 | 0,89 | 0,82 |
| dvidešimt | Kalcis | Tai | 40 078 | 1.55 | 1 |
| dvidešimt vienas | Skandis | Sc | 44.9559 | 2 985 | 1.36 |
| 22 | Titanas | Apie | 47 867 | 4 506 | 1.54 |
| 23 | Vanadis | IN | 50.9415 | 6.11 | 1.63 |
| 24 | Chromas | Kr | 51.9961 | 7.15 | 1.66 |
| 25 | Manganas | Mn | 54 938 | 7.21 | 1.55 |
| 26 | Geležis | Tikėjimas | 55 845 | 7 874 | 1.83 |
| 27 | Kobaltas | Co | 58,9332 | 8.9 | 1.88 |
| 28 | Nikelis | Į | 58.6934 | 8 908 | 1.91 |
| 29 | Varis | Su | 63 546 | 1.9 | 60 |
| 30 | Cinkas | Zn | 65.39 | 1.65 | 70 |
| 31 | Galis | Čia | 69 723 | 1.81 | 19 |
| 32 | germanis | Ge | 72.64 | 2.01 | 1.5 |
| 33 | Arsenas | Kaip | 74.9216 | 2.18 | 1.8 |
| 3. 4 | Selenas | JIS | 78,96 | 2.55 | 0,05 |
| 35 | Bromas | Br | 79 904 | 2.96 | 2.4 |
| 36 | Kriptonas | NOK | 83 798 | 3 | 1×10−4 |
| 37 | Rubidis | Rb | 85.4678 | 0,82 | 90 |
| 38 | Stroncis | Sr | 87.62 | 0,95 | 370 |
| 39 | Itris | IR | 88 906 | 1.22 | 33 |
| 40 | Cirkonis | Zr | 91 224 | 1.33 | 165 |
| 41 | Niobis | Nb | 92 906 | 1.6 | dvidešimt |
| 42 | Molibdenas | Mo | 95,94 | 2.16 | 1.2 |
| 43 | Techneciumas | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | rutenis | Ru | 101.07 | 2.2 | 0,001 |
| Keturi | Rodis | Rh | 102.91 | 2.28 | 0,001 |
| 46 | Paladis | Pd | 106.42 | 2.2 | 0,015 |
| 47 | sidabras | At | 107.87 | 1.93 | 0,075 |
| 48 | kadmis | Cd | 112 411 | 1.69 | 0,159 |
| 49 | Indis | Į | 114,82 | 1.78 | 0.25 |
| penkiasdešimt | Tikėti | Sn | 118,71 | 1.96 | 23 |
| 51 | Stibis | Sb | 121,76 | 2.05 | 0.2 |
| 52 | Telūras | The | 127.6 | 2.1 | 0,001 |
| 53 | Jodas | aš | 126.9045 | 2.66 | 0,45 |
| 54 | Ksenonas | Automobilis | 131 293 | 2.6 | 3×10−5 |
| 55 | Cezis | Cs | 132,91 | 0,79 | 3 |
| 56 | Baris | Ne | 137 327 | 0,89 | 425 |
| 57 | Lantanas | The | 138,91 | 1.1 | 39 |
| 58 | Ceris | Tai | 140.12 | 1.12 | 66.5 |
| 59 | Prazeodimis | Pr | 140.9077 | 1.13 | 9.2 |
| 60 | Neodimis | Nd | 144.24 | 1.14 | 41.5 |
| 61 | Prometis | pm | 145 | 1.13 | 2×10−19 |
| 62 | Samariumas | Sm | 150.36 | 1.17 | 7.05 |
| 63 | Europiu | Eu | 151 964 | 1.2 | 2 |
| 64 | Gadolinis | Gd | 157.25 | 1.2 | 6.2 |
| 65 | Terbis | Tb | 158.9253 | 1.2 | 1.2 |
| 66 | Disprosis | Tie | 162,5 | 1.22 | 5.2 |
| 67 | Holmium | Į | 164.9303 | 1.23 | 1.3 |
| 68 | Erbis | Is | 167 259 | 1.24 | 3.5 |
| 69 | Tulis | Tm | 168.9342 | 1.25 | 0,52 |
| 70 | Iterbis | Yb | 173.04 | 1.1 | 3.2 |
| 71 | Paryžius | Lu | 174 967 | 1.27 | 0.8 |
| 72 | Hafnis | Hf | 178.49 | 1.3 | 3 |
| 73 | Tantalas | Atviras | 180.9479 | 1.5 | 2 |
| 74 | Volframas | IN | 183,84 | 2.36 | 1.3 |
| 75 | Renis | Re | 186 207 | 1.9 | 7×10−4 |
| 76 | Osmis | Tu | 190.23 | 2.2 | 0,002 |
| 77 | Iridiumas | Ir | 192.22 | 2.2 | 0,001 |
| 78 | Platina | Pt | 195.08 | 2.28 | 0,005 |
| 79 | Auksas | At | 196,97 | 2.54 | 0,004 |
| 80 | Merkurijus | Hg | 200,59 | 2 | 0,085 |
| 81 | Talis | Tl | 204.3833 | 1.62 | 0,85 |
| 82 | Vadovauti | Pb | 207.2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Bismutas | Su | 208.9804 | 2.02 | 0,009 |
| 84 | Polonis | Po to | 209 | 2 | 2×10−10 |
| 85 | Astatinas | At | 210 | 2.2 | 3×10−20 |
| 86 | Radonas | Rn | 222 | 2.2 | 4×10−13 |
| 87 | Francium | Kun | 223 | >0,79[6] | ~ 1×10−18 |
| 88 | Radis | Saulė | 226 | 0.9 | 9×10−7 |
| 89 | Aktinis | Ir | 227 | 1.1 | 5,5×10−10 |
| 90 | Toris | Th | 232.0381 | 1.3 | 9.6 |
| 91 | Protaktinis | Na | 231.0359 | 1.5 | 1,4×10−6 |
| 92 | Uranas | IN | 238.0289 | 1.38 | 2.7 |
| 93 | Neptūnas | Pvz | 237 | 1.36 | ≤ 3×10−12 |
| 94 | Plutonis | Galėtų | 244 | 1.28 | ≤ 3×10−11 |
| 95 | Americium | Esu | 243 | 1.13 | – |
| 96 | Kurijus | Cm | 247 | 1.28 | – |
| 97 | Berkelija | Bk | 247 | 1.3 | – |
| 98 | Kalifornija | Plg | 251 | 1.3 | – |
| 99 | Einšteinas | Is | 252 | 1.3 | – |
| 100 | Fermis | Fm | 257 | 1.3 | – |
| 101 | Mendelejevas | Md | 258 | 1.3 | – |
| 102 | kilnus | Nr | 259 | 1.3 | – |
| 103 | Lawrenciumas | Lr | 262 | 1.3 | – |
| 104 | Rutherfordiumas | Rf | 267 | – | – |
| 105 | Dubnium | Db | 268 | – | – |
| 106 | Seaborgiumas | Sg | 269 | – | – |
| 107 | Bohrium | Bh | 270 | – | – |
| 108 | Hasis | Hs | 269 | – | – |
| 109 | Meitnerium | Mt | 277 | – | – |
| 110 | Darmstadtis | Ds | 281 | – | – |
| 111 | Rentgenijus | Rg | 282 | – | – |
| 112 | Kopernikas | Cn | 285 | – | – |
| 113 | Nihonis | Nh | 286 | – | – |
| 114 | Flerovium | Į | 290 | – | – |
| 115 | Maskva | Mc | 290 | – | – |
| 116 | Livermoriumas | Lv | 293 | – | – |
| 117 | Tenesinas | Ts | 294 | – | – |
| 118 | Oganessonas | Ir | 294 | – | – |
Svarbūs terminai periodinėje lentelėje
| Sąlygos kaip konvertuoti eilutę į char | apibūdinimas |
|---|---|
| Atominis skaičius | Protonų, sudarančių elemento branduolį, skaičius vadinamas jo atominiu skaičiumi (Z). pvz. Tuomet anglyje yra 6 protonai, todėl jos atominis skaičius turi būti tik 6. |
| Atominė masė | Ji apibrėžiama kaip vidutinė elemento atomų masė. Jis matuojamas remiantis santykiniu natūraliu elemento izotopų gausumu. Atominė masė Taip pat vadinamas atominiu svoriu (A). Jis matuojamas atominės masės vienetu (amu). |
| Laikotarpis | Horizontalios eilutės iš kairės į dešinę periodinėje lentelėje vadinamos laikotarpiais. Iš viso periodinėje lentelėje yra 7 laikotarpiai. Elementai yra išdėstyti horizontaliai dėl jų savybių panašumų, pavyzdžiui, tos pačios atominės orbitos ir pan. |
| Grupė | Vertikalūs stulpeliai iš viršaus į apačią periodinėje lentelėje vadinami grupėmis. Iš viso periodinėje lentelėje yra 18 grupių. Elementai yra išdėstyti vertikaliai dėl savo savybių panašumų, nes juose yra tiek pat valentinių elektronų. |
| Elemento simbolis | Simbolis yra sąvoka, naudojama cheminiam elementui pavaizduoti naudojant raidę arba dviejų ar trijų raidžių derinį. pvz. Cheminis anglies simbolis yra C, o Fe naudojamas kaip geležis ir pan. |
Elementų klasifikacija periodinėje lentelėje
118 elementų yra suskirstyti į 7 periodus ir 18 grupių, kaip parodyta aukščiau. Be to, elementai yra suskirstyti į skirtingus blokus.
| Blokuoti | Įtraukti elementai | Užpildytas paskutinis elektroninis apvalkalas |
|---|---|---|
| s-blokas | 1 grupė (šarminiai metalai) | s-subshell |
| 2 grupė (šarminių žemių metalai) | ||
| p blokas | 13 grupė (boro šeima) | p-subshell |
| 14 grupė (anglies šeima) | ||
| 15 grupė (azoto šeima) | ||
| 16 grupė (deguonies šeima) | ||
| 17 grupė (fluoro šeima) | ||
| d blokas | 3–12 grupės (pereinamieji elementai) | d-subshell |
| f blokas | Lantanidai (retųjų žemių elementai) | f-subshell |
| Aktinidai |
Mendelejevo periodinė lentelė
Siekdamas pavaizduoti elementų elgesio panašumus ir tendencijas, Mendelejevas sukūrė periodinę lentelę, kuri yra elementų išdėstymas didėjančios atominės masės tvarka lentelės pavidalu.

Remiantis Mendelejevo periodine lentele, elementai buvo išdėstyti pagal jų pagrindines savybes, atominę masę ir chemines savybes. Mendelejevo darbo metu buvo žinomi tik 63 elementai. Mendelejevo periodinėje lentelėje horizontali eilutė ir vertikalios stulpeliai buvo atitinkamai vadinami grupėmis ir laikotarpiais.
Tačiau Mendelejevo periodinė lentelė žlunga dėl daugelio joje esančių trūkumų. Kai kurie iš jų yra tokie, kad jame nepavyko nurodyti vandenilio ir tauriųjų dujų. Be to, didėjanti elementų atominės masės tvarka visoje lentelėje nebuvo reguliari. Netgi izotopų atradimas pažeidžia Mendelejevo periodinį įstatymą.
Skaityti daugiau:
- Šiuolaikinė periodinė lentelė
- Mendelejevo periodinė lentelė
- Šiuolaikinė periodinė teisė
- Periodinės lentelės istorija
- Atominė struktūra
DUK apie periodinę elementų lentelę
Kas yra periodinė elementų lentelė?
Periodinė elementų lentelė yra cheminių elementų lentelė, suskirstyta pagal jų atominį skaičių, elektronų konfigūraciją ir pasikartojančias chemines savybes. Lentelė yra padalinta į eilutes, vadinamas taškais, ir stulpelius, vadinamas grupėmis arba šeimomis.
Kas atrado periodinę elementų lentelę?
Periodinę elementų lentelę atrado ne vienas žmogus, tačiau jos sukūrimo autorius yra rusų chemikas Dmitrijus Mendelejevas, kuris 1869 m. sutvarkė elementus pagal jų savybes.
Kas sukūrė šiuolaikinę periodinę lentelę?
1913 m. Henry Moseley pristatė atnaujintą periodinės lentelės versiją, paprastai vadinamą Šiuolaikine periodine lentele.
Kaip išdėstyta periodinė lentelė?
Periodinė lentelė yra išdėstyta didėjančio atominio skaičiaus tvarka, o elementai sugrupuoti pagal panašias chemines savybes ir suskirstyti į periodus (eilutes) ir grupes (stulpelius).
Kas yra atominis skaičius?
Protonų, sudarančių elemento branduolį, skaičius vadinamas jo atominiu skaičiumi (Z). pvz. Tuomet anglyje yra 6 protonai, jos atominis skaičius turi būti tik 6.
Ar gali du skirtingi elementai turėti tą patį atominį skaičių?
Neutronų skaičius atome iš dviejų skirtingų elementų gali būti panašus, tačiau protonų skaičius niekada nebus toks pat. Kiekvienas elementas turi tam tikrą protonų skaičių, kuris atitinka atomų skaičių.
Kaip apskaičiuoti atominę masę?
Atominė masė gali būti apskaičiuojama pridedant protonų ir neutronų masę elemente.
Kas yra grupė periodinėje lentelėje?
Periodinės lentelės stulpelis nurodo periodinės lentelės grupę. Tos pačios grupės elementai turi panašias fizines ir chemines savybes.
