Sąvoka hibridizacija apibrėžiamas kaip dviejų atominių orbitalių sujungimo procesas, siekiant sukurti naujo tipo hibridizuotas orbitas. Dėl šio susimaišymo paprastai susidaro hibridinės orbitalės, kurių energija, forma ir pan. Hibridizaciją pirmiausia atlieka to paties energijos lygio atominės orbitos. Tačiau ir visiškai užpildytos, ir pusiau užpildytos orbitos gali dalyvauti šiame procese, jei jų energija yra vienoda. Hibridizacijos sąvoka yra valentinio ryšio teorijos išplėtimas, padedantis suprasti ryšio formavimąsi, ryšio energijas ir ryšių ilgį.
Kas yra Hibridizacija?
Kai dvi atominės orbitalės susijungia ir sudaro hibridinę orbitalę molekulėje, atskirų atomų orbitalių energija perskirstoma, kad būtų gautos lygiavertės energijos orbitalės. Tai žinoma kaip hibridizacija.
Palyginamų energijų atominės orbitalės sumaišomos hibridizacijos proceso metu, kuris dažniausiai apima dviejų orbitalių arba dviejų „p“ orbitalių sujungimą arba „s“ orbitalės sumaišymą su „p“ orbitale ir „s“ orbitalė su „d“ orbitale.
Hibridinės orbitos yra naujos orbitos, susidariusios dėl šio proceso. Dar svarbiau, kad hibridinės orbitalės gali būti naudojamos atominių ryšių savybėms ir molekulinei geometrijai paaiškinti. Pavyzdžiui, anglis sudaro keturias pavienes jungtis, kuriose valentinio apvalkalo orbitalė susijungia su trimis valentinės apvalkalo p orbitalės. Šis derinys sukuria keturis lygiaverčius sp3mišiniai. Jie bus išdėstyti tetraedriniu būdu aplink anglį, kuri yra sujungta su keturiais skirtingais atomais.
Hibridizacijos tipo nustatymo veiksmai
Norint suprasti atomo ar jono hibridizacijos tipą, reikia laikytis šių taisyklių.
- Pirmiausia nustatykite bendrą valentinių elektronų, esančių atome arba jone, skaičių.
- Tada suskaičiuokite vienišų porų, prijungtų prie to atomo ar jono, skaičių.
- Dabar reikiamą orbitų skaičių galima apskaičiuoti pridedant duplekso arba okteto skaičių ir vienišų elektronų porų skaičių.
- Reikėtų pažymėti, kad atomų ar jonų orbitalių geometrija skiriasi, kai nėra vienišų elektronų poros.
Hibridizacijos ypatybės
- Hibridizacija vyksta tarp vienodos energijos atomų orbitų.
- Susidariusių hibridinių orbitų skaičius yra lygus susimaišiusių atominių orbitalių skaičiui.
- Nebūtina, kad visos pusiau užpildytos orbitos dalyvautų hibridizacijoje. Gali dalyvauti net visiškai užpildytos, bet šiek tiek kitokios energijos orbitos.
- Hibridizacija vyksta tik susidarant ryšiui, o ne viename dujiniame atome.
- Jei žinoma molekulės hibridizacija, galima numatyti molekulės formą.
- Didesnė hibridinės orbitos skiltis visada yra teigiama, o mažesnė, esanti priešingoje pusėje, visada yra neigiama.
Tipai hibridizacijos
Hibridizacija gali būti klasifikuojama kaip sp3, sp2, sp., sp3d, sp3d2, arba sp3d3remiantis maišymo procese dalyvaujančių orbitų tipais.
sp Hibridizacija
Tai atsitinka, kai viena s ir viena p orbitalė pagrindiniame atomo apvalkale susijungia ir sudaro dvi naujas lygiavertes orbitales. Naujai suformuotos orbitos yra žinomos kaip sp hibridizuotos orbitos. Jis gamina linijines molekules 180° kampu. Tai reiškia, kad reikia sujungti savo orbitą ir vieną vienodos energijos „p“ orbitalę, kad būtų sukurta nauja hibridinė orbitalė, vadinama sp hibridizuota orbitale.
isempty java
- Tai taip pat žinoma kaip įstrižainė hibridizacija.
- Kiekvienoje sp hibridizuotoje orbitoje yra tiek pat s ir p simbolių.
- Visi berilio junginiai, tokie kaip BeF2, Na2ir BeCl2, yra pavyzdžiai.

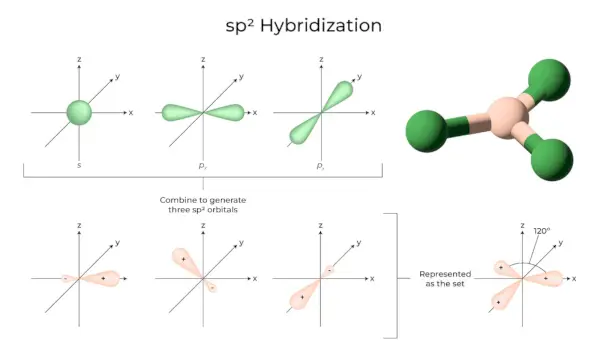
sp2Hibridizacija
Tai atsitinka, kai viena s ir dvi to paties atomo apvalkalo orbitalės susijungia ir sudaro tris lygiavertes orbitales. Naujai suformuotos orbitos yra žinomos kaip sp2hibridinės orbitos. Tai taip pat žinoma kaip trigonalinė hibridizacija. Tai reiškia, kad reikia sujungti savo orbitą su dviem vienodos energijos „p“ orbitomis, kad būtų sukurta nauja hibridinė orbitalė, vadinama sp2. Trigonalinės simetrijos s ir p orbitalių mišinys laikomas 120 laipsnių kampu. Visos trys hibridinės orbitos lieka toje pačioje plokštumoje ir sudaro 120° kampą viena su kita.
- Kiekviena suformuota hibridinė orbita turi 33,33 % ir 66,66 % „p“ charakterį.
- Trikampės plokštumos molekulės turi centrinį atomą, susietą su trimis kitais atomais ir yra sp2hibridizuotas. Boro junginiai yra pavyzdžiai.
sp3Hibridizacija
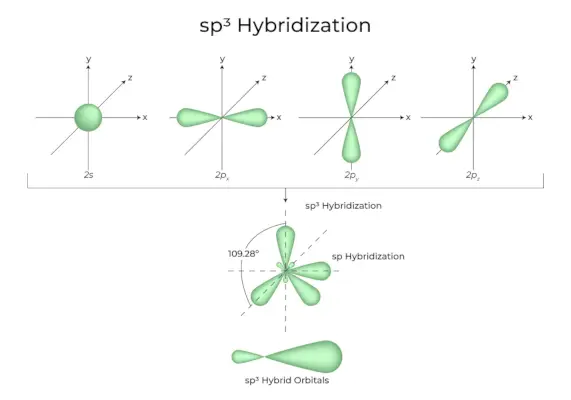
Kai viena „s“ orbitalė ir trys „p“ orbitalės iš to paties atomo apvalkalo susijungia ir sudaro keturias naujas lygiavertes orbitales, hibridizacija vadinama tetraedrine hibridizacija arba sp.3. Naujai suformuotos orbitos yra žinomos kaip sp3hibridinės orbitos. Jie yra nukreipti į keturis taisyklingo tetraedro kampus ir sudaro 109°28′ kampą vienas su kitu.
- Sp3hibridinės orbitos sudaro 109,28 laipsnių kampą.
- Kiekviena hibridinė orbita turi 25 % s ir 75 % p simbolį.
- Etanas ir metanas yra du pavyzdžiai.
sp3d Hibridizacija
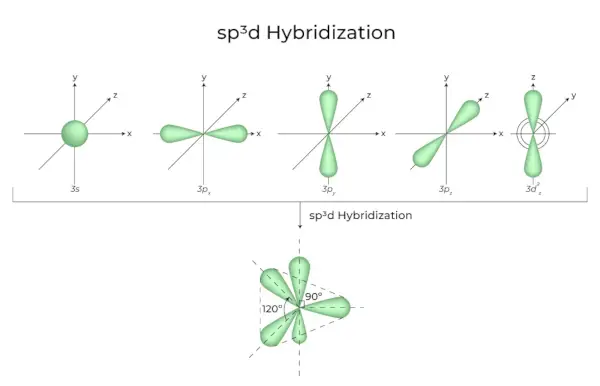
Sumaišius 1s orbitales, 3p orbitales ir 1d orbitales, susidaro 5 sp3d hibridizuotos vienodos energijos orbitalės. Jų geometrija yra trikampė bipiramidinė. S, p ir d orbitalių derinys lemia trigonalinę bipiramidinę simetriją. Pusiaujo orbitalės yra trys hibridinės orbitalės, orientuotos viena kitos atžvilgiu 120° kampu ir gulinčios horizontalioje plokštumoje.
- Likusios dvi orbitalės, žinomos kaip ašinės orbitalės, yra vertikalioje plokštumoje 90 laipsnių kampo pusiaujo orbitalių plokštumoje.
- Hibridizacija, pavyzdžiui, fosforo pentachloride (PCl5).
sp3d2 Hibridizacija
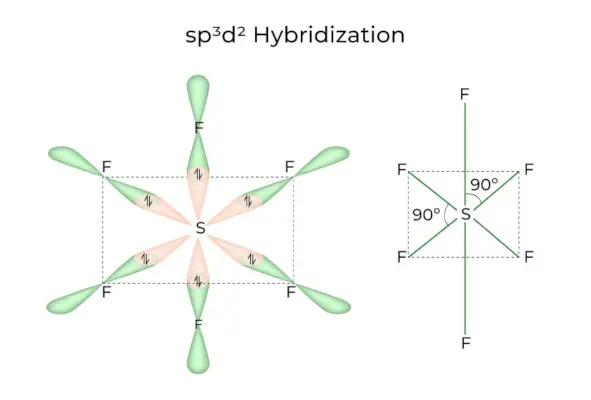
Kai 1s, 3p ir 2d orbitos susijungia ir sudaro 6 vienodus sp3d2hibridinės orbitos, hibridizacija vadinama sp3d2Hibridizacija. Šios septynios orbitos nukreiptos į oktaedro kampus. Jie vienas kito atžvilgiu yra pasvirę 90 laipsnių kampu.
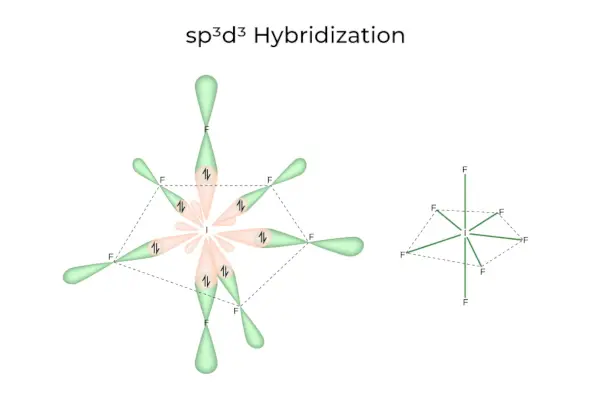
sp3d3Hibridizacija
Jis turi 1s, 3p ir 3d orbitales, kurios susijungia ir sudaro 7 vienodus sp3d3hibridinės orbitos. Šios septynios orbitos nukreiptos į penkiakampės bipiramidės kampus. pvz. JEI6.
Hibridizacijos formos
- Linijinis: sp hibridizaciją sukelia dviejų elektronų grupių sąveika; orbitos kampas yra 180°. Trigonalinė plokštuma: dalyvauja trys elektronų grupės, todėl sp2hibridizacija; orbitos yra 120° atstumu viena nuo kitos. Tetraedras: dalyvauja keturios elektronų grupės, todėl sp3hibridizacija; orbitos kampas yra 109,5°. Trigonalinis bipiramidinis: dalyvauja penkios elektronų grupės, todėl sp3d hibridizacija; orbitos kampai yra 90° ir 120°. Oktaedras: dalyvauja šešios elektronų grupės, todėl sp3d2hibridizacija; orbitos yra 90° atstumu viena nuo kitos.
DUK įjungti Hibridizacija
1 klausimas: kuri hibridinė orbita tarp sp, sp2 ir sp3 yra labiau elektronegatyvesnė?
Atsakymas:
S simbolio procentas sp, sp2, ir sp3hibridizuotos anglies yra atitinkamai 50%, 33,33% ir 25%. Dėl sferinės orbitos formos branduolys ją tolygiai traukia iš visų krypčių. Dėl to hibridinė s simbolio orbita bus arčiau branduolio ir tokiu būdu elektronegatyvesnė. Dėl to sp hibridizuota anglis yra elektronegatyviausia.
2 klausimas: kas yra hibridinės orbitos?
Atsakymas:
mylivecricket žaisti gyvą kriketą
Hibridinės orbitalės susidaro sujungiant standartines atomines orbitales ir dėl to susidaro naujos atominės orbitalės.
3 klausimas: kokios yra penkios hibridizacijos formos?
Atsakymas:
Linijinė, trikampė plokštuma, tetraedrinė, trigoninė bipiramidinė ir aštuonkampė yra penkios pagrindinės hibridizacijos formos.
4 klausimas: kodėl amido molekulė atrodo kaip sp3hibridizuotas, bet yra sp2?
Atsakymas:
Jei atomas yra apsuptas dviejų ar daugiau p orbitalių arba turi vieną porą, galinčią peršokti į p orbitalę, bendras hibridizacijos procesas pasikeis. Dėl to amido molekulės atveju vieniša pora patenka į p orbitalę, todėl susidaro trys gretimos lygiagrečios p orbitalės.
5 klausimas: kokia yra Bento taisyklė?
Atsakymas:
Centrinis atomas, sujungtas su daugybe molekulės grupių, hibridizuosis, todėl orbitos, turinčios daugiau s, bus nukreiptos į elektroteigiamus grupes, o orbitos, turinčios daugiau p charakterio, bus nukreiptos į elektronegatyvias grupes.
